Solutions codes-barres et RFID dans le secteur de la santé
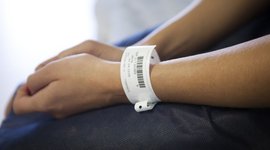
Que ce soit dans les hôpitaux ou les laboratoires, pour les produits médicaux ou dans l'industrie pharmaceutique - un étiquetage correct et sans ambiguïté peut être vital dans l'environnement médical. Dans un contexte de pression croissante sur les coûts dans les hôpitaux et les cliniques ainsi que d'exigences réglementaires et légales de plus en plus strictes en matière de produits médicaux et de médicaments, elle garantit aux patients des soins optimaux à tout moment. Les solutions de codes à barres et RFID d'inotec offrent tout cela et bien plus encore. Vous pouvez compter sur notre longue expérience et notre large éventail de solutions de codage et de marquage spécialement adaptées aux défis du secteur de la santé. Quelle que soit la contrainte mécanique, thermique ou chimique à surmonter, nous trouverons ensemble une solution adaptée ! Des étiquettes de poches de sang à l'UDI en passant par l'inviolabilité, nous offrons des conseils, le développement et la production à partir d'une seule et même source.
L'AVANTAGE INOTEC:
- Des solutions de marquage adaptées à vos conditions individuelles
- Marquage clair pour l'application des directives en vigueur
- Étiquettes inviolables pour une protection maximale du produit
- Sérialisation pour garantir l'exclusion des numéros en double et une traçabilité sans problème - même à l'échelle mondiale
- Possibilité de connexion au logiciel Track & Trace basé sur le cloud : pour un accès facile à partir de différents terminaux
- Traçabilité complète de tous les dispositifs médicaux en temps réel
- Sur demande : étiquettes de protection des produits dans votre propre design
- Conseil, service complet et suivi à long terme par nos experts
Gestion des actifs et Track & Trace dans l'environnement médical Rien ne se perd ici
inotec Barcode RFID Track Trace Hôpital Inventaire

Savoir à tout moment quel est l'état actuel de l'inventaire et où se trouvent vos produits - aucun problème avec les solutions Track & Trace basées sur le cloud. Elles vous permettent en effet de visualiser en temps réel le lieu d'utilisation de vos dispositifs médicaux. Avec nos solutions sérialisées à code-barres et RFID, l'incertitude et les mauvaises surprises appartiennent au passé. Au lieu de cela, vous pouvez suivre sans faille l'endroit où vos appareils sont utilisés. Cela permet d'éviter les goulots d'étranglement et les investissements inutiles. Les grands laboratoires, les hôpitaux ou les réseaux de cliniques sont les premiers à profiter de cette transparence de l'inventaire.
Protection des produits pour le secteur médical et pharmaceutique En toute sécurité
inotec Photo of Etiquettes de sécurité pour la protection des produits inoverify

Les dommages causés à l'image de marque et les conséquences potentiellement mortelles pour les patients par l'utilisation inconsciente de produits contrefaits sont un problème croissant, d'autant plus que les contrefaçons sont de plus en plus difficiles à détecter. Avec les solutions de protection des produits d'inotec, comme inoVerify, vous pouvez désormais garantir à vos clients la sécurité qu'ils méritent. Des différentes caractéristiques de sécurité ouvertes ou cachées à la sérialisation avec traçabilité globale, en passant par les étiquettes inviolables, inotec vous offre une protection absolue des produits adaptée à vos exigences. Et ce, bien entendu, dans votre design.
La directive UDI pour les dispositifs médicaux
Quand l'identification claire devient obligatoire inotec Barcode RFID Track&Trace Inventaire médical

À l'avenir, chaque produit médical devra être marqué de manière univoque et donc identifiable dans le monde entier. Cela se fera à l'aide de l'Unique Device Identification, ou UDI. Au niveau européen, l'introduction de ce marquage est régie par le Medical Device Regulation (MDR). Elle a été introduite dès 2017 et entre désormais progressivement en vigueur. Pour l'introduction et la mise en œuvre, le règlement a recours à une approche basée sur les risques, c'est-à-dire que les produits de la classe de risque III doivent être étiquetés en premier et les produits de la classe I (jusqu'en 2027) en dernier. Cela doit permettre de mieux garantir la sécurité des patients et la traçabilité des dispositifs médicaux. Pour ce faire, chaque produit recevra une identification sous la forme d'un code numérique et d'un code-barres ou d'un code 2D. L'idée est la suivante : Le code numérique est lisible par l'homme, le code-barres par les machines. Si le produit est très petit, le code lisible par la machine est également suffisant. Les exigences UDI sont désormais un élément important de l'évaluation de la conformité pour l'obtention du marquage CE.
Éléments de l'étiquetage UDI
UDI-DI et UDI-PI
L'UDI se compose de deux parties : l'identifiant du produit (UDI-DI) et l'identifiant de la production (UDI-PI).
Le premier (UDI-DI) sert à identifier le produit et le fabricant, il doit être apposé sur le produit lui-même et, en plus, sur son emballage. Il est attribué par l'organisme d'attribution responsable et est fixe. Il contient jusqu'à 20 données, telles que des informations sur le nom commercial, la possibilité de réutilisation, la stérilité, etc. Ce dernier (UDI-PI) est attribué par l'organisme d'attribution compétent. Le second (UDI-PI) marque le lot d'un produit, par exemple les numéros de lot, les numéros de série, les dates d'expiration et/ou de fabrication et est attribué par le fabricant lui-même.
UDI-DI de base
L'UDI-DI de base a un rôle particulier. Il identifie des produits similaires ayant la même finalité et la même classe de risque, mais qui diffèrent légèrement, par exemple au niveau de la puissance du moteur. Cela en fait une sorte d'identifiant de modèle. Bien qu'il fonctionne comme une clé pour la base de données UDI EUDAMED, il n'apparaît toujours pas sur le produit ou l'emballage, mais est spécifié par les fabricants avec d'autres éléments de données dans la base de données UDI. Les fabricants doivent également tenir une liste de tous les UDI attribués pour chaque dispositif médical. Cela fait partie de la documentation technique.
UDI sur les emballages
En outre, à partir de 2021, les fabricants de dispositifs médicaux devront non seulement marquer successivement les produits eux-mêmes (en fonction de la classe du dispositif médical), mais aussi leur emballage (exception : les conteneurs) avec l'UDI. La règle suivante s'applique ici : le code doit rester lisible pendant toute la durée de vie. Cela s'applique à tous les dispositifs médicaux.
Étiquetage UDI : exigence légale importante, mais associée à des dépenses supplémentaires
Avec la directive UDI, l'UE fait un grand pas en avant dans le domaine de la sécurité des patients dans les secteurs médical et pharmaceutique grâce à un étiquetage clair et une traçabilité complète. Néanmoins, les fabricants concernés ne sont pas exempts d'obstacles et la mise en œuvre peut difficilement être maîtrisée sans des conseils compétents et un partenaire expérimenté. Nos experts se tiennent donc à votre disposition pour répondre à toutes vos questions et préoccupations concernant l'étiquetage avec l'UDI.